|
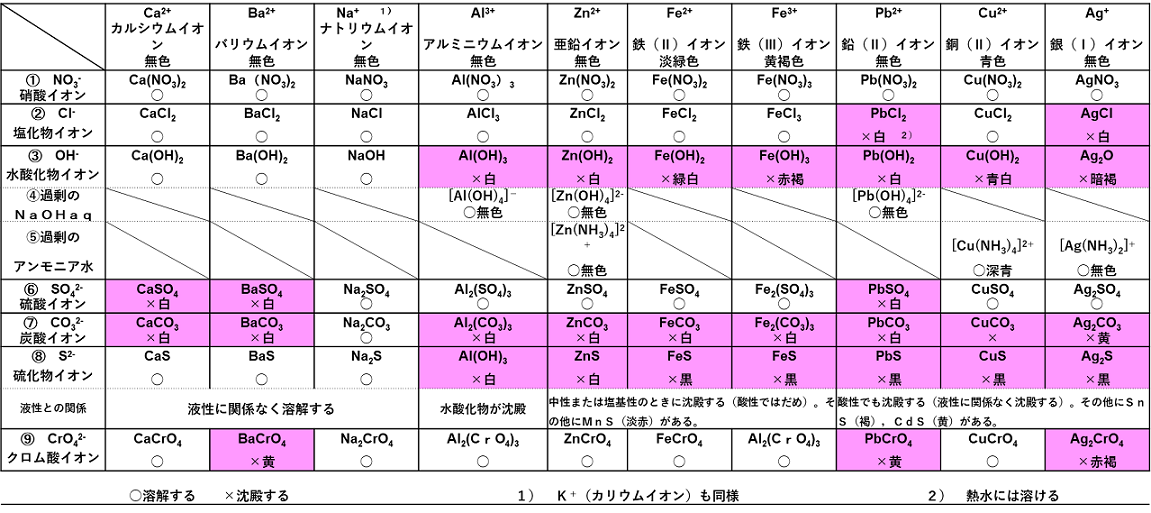
6 金属イオンの沈殿反応 金属のイオンは,さまざまな陰イオンによって沈殿させることができる。各金属イオンがどの陰イオンで沈殿するのかを,次の表や図によって覚えよう。 表で覚える |
 |
|
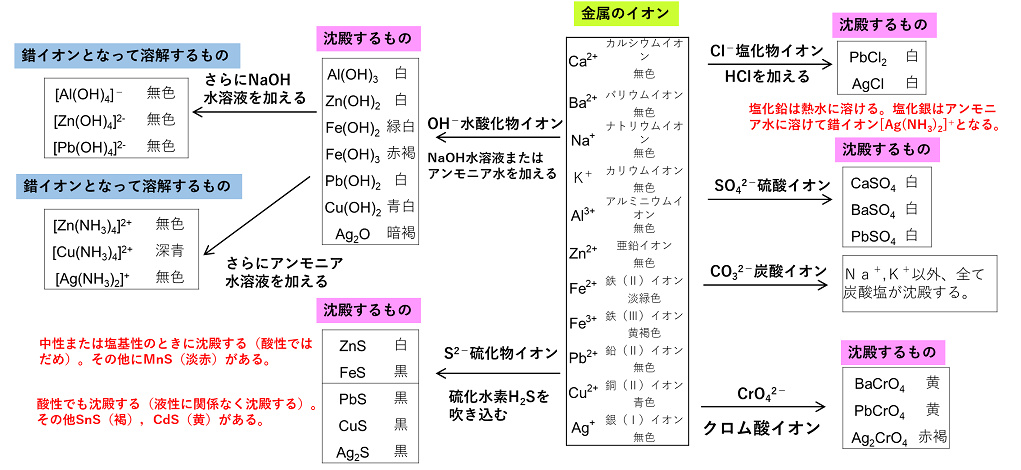
陰イオンごとに覚える ① 硝酸イオンNO3-で沈殿するものはない。 ② Cl-を加えると沈殿する金属イオン ・・・ Ag+,Pb2+ PbCl2は熱湯に溶ける。AgClは日光を当てると黒っぽい色に変色。また,AgClはアンモニア水に溶解し,錯イオンとなって,無色の水溶液になる。 ③ OH-によって沈殿しない金属イオン ・・・K+,Na+, Ba2+, Ca2+, NH4+ ④ 過剰のNaOH水溶液に溶ける水酸化物 ・・・Al(OH)3 ,Zn(OH)2 ⑤ 過剰のアンモニア水溶液に溶ける水酸化物 ・・・Cu(OH)2 ,Zn(OH)2 , Ag2O ⑥ SO42-を加えると沈殿する金属イオン ・・・ Ba2+, Ca2+,Pb2+ ⑦ CO32-によって沈殿しない金属イオン ・・・ Na+,K+,NH4+(金属ではないが同じように考える) ⑧ H2Sとの反応 沈殿しないイオン ・・・ K+,Na+,Mg2+,Al3+, Ba2+, Ca2+, NH4+ 水溶液が中性・塩基性のとき沈殿するイオン ・・・ Fe2+,Zn2+(この他はあまり出ない) 水溶液が酸性でも(どんなときでも)沈殿するイオン ・・・ Pb2+, Cu2+, Ag+(この他はあまり出ない) ⑨ CrO42-によって沈殿するイオン ・・・ Ba2+,Pb2+,Ag+ ⑩その他の金属イオンの検出 ・・・ ネスラー試薬で黄~褐色の沈殿 ⇒ NH4+ |
|
図で覚える |
 |
|
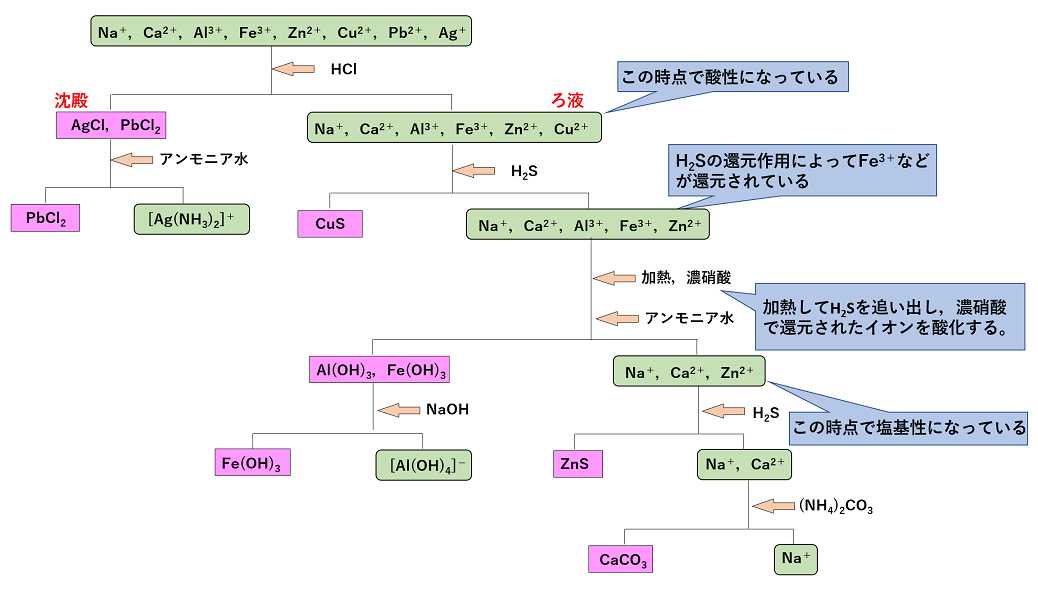
【金属イオンの分離】 金属イオンの沈殿反応を参考に考える。 |
 |
|
硫化水素H2Sによる沈殿の生成と液性について 金属イオンの硫化水素による沈殿の生成では,Pb2+,Cu2+,Ag+などは液性がどのような場合でも(酸性の場合でも)硫化物の沈殿が生じる。一方,Zn2+やFe2+などは液性が中性~塩基性の場合で(酸性の場合はだめ)硫化物の沈殿が生じる。 これは,それぞれの金属イオンからなる硫化物の溶解度積と関係がある。 |
|
25℃,水における溶解度積Ksp(イオン積の値がKspを超えると沈殿が生じる) 
|
|
硫化水素は,水に対する溶解度(5g/L,20℃)から,水に吹き込むとおよそ0.1〔mol/L〕となる。また,水溶液中では一部が電離し,硫化物イオンS2-を生成する。 H2S ⇄ 2H+ + S2- K=[H+]2[S2-]/[H2S]= 1.2×10-21(mol/L)2 これより,[S2-] = 1.2×10-21[H2S]/[H+]2 ≒ 1.2×10-22/[H+]2 pH=1.0の場合は,[H+]=1.0×10-1より,[S2-]=1.2×10-20。pH=5.0以上では,計算上[S2-]は0.1〔mol/L〕を超え,完全に電離していると考えられるので[S2-]=0.1。 各金属イオンが1.0×10-3〔mol/L〕であるならば,pH=1.0([S2-]=1.2×10-20)のときに硫化物の沈殿が生じる(金属イオンとS2-のイオン積がそのKspを超える)のは,PbS,SnS,CdS,CuS,Ag2Sである。また中性~塩基性([S2-]=0.1)では,上記の硫化物はすべて沈殿する。 |
 |